Fuente: Portalciencia
"El enfermo, el anciano y el herido sufren una desorganización de los átomos provocada por un virus, el paso del tiempo o un accidente de coche", escribía Eric Drexler en su obra Engines of Creation en 1986. "En el futuro habrá aparatos capaces de reorganizar los átomos y colocarlos en su lugar". Con estas palabras preconizaba la revolución que ha supuesto la aplicación de los conocimientos y las tecnologías del nanocosmos a la medicina. Hoy por hoy, la nanomedicina es ya una realidad que está produciendo avances en el diagnóstico, la prevención y el tratamiento de las enfermedades.
Cápsulas que navegan por la sangre
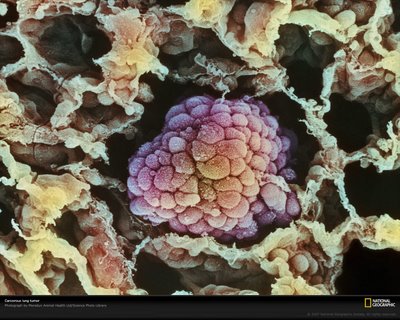
El matrimonio entre medicina y nanotecnología se está convirtiendo en una 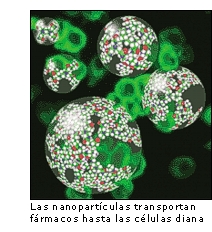 pesadilla para el cáncer. El combate de la enfermedad a escala molecular permite detectar precozmente la enfermedad, identificar y atacar de forma más específica a las células cancerígenas. Por eso, el Instituto Nacional del Cáncer de Estados Unidos (NCI) ha puesto en marcha la "Alianza para la nanotecnología en el cáncer", un plan que incluye el desarrollo y creación de instrumentos en miniatura para la detección precoz.
pesadilla para el cáncer. El combate de la enfermedad a escala molecular permite detectar precozmente la enfermedad, identificar y atacar de forma más específica a las células cancerígenas. Por eso, el Instituto Nacional del Cáncer de Estados Unidos (NCI) ha puesto en marcha la "Alianza para la nanotecnología en el cáncer", un plan que incluye el desarrollo y creación de instrumentos en miniatura para la detección precoz.
En la administración de medicamentos, las nuevas técnicas son ya un hecho. "Los nanosistemas de liberación de fármacos actúan como transportadores de fármacos a través del organismo, aportando a estos una mayor estabilidad frente a la degradación, y facilitando su difusión a través de las barreras biológicas y, por lo tanto el acceso a las células diana", explica María José Alonso, investigadora de la Universidad de Santiago de Compostela, que trabaja en esta línea desde 1987. En el tratamiento del cáncer, asegura, "estos nanosistemas facilitan el acceso a las células tumorales y reducen la acumulación del fármaco en las células sanas y, por tanto, reducen los efectos tóxicos de los antitumorales".
Desde Estados Unidos, el nanotecnológo James Baker ha desarrollado otra alternativa basada en unas moléculas artificiales conocidas como dendrímeros. Se trata de estructuras tridimensionales ramificadas que pueden diseñarse a escala nanométrica con extraordinaria precisión. Los dendrímeros cuentan con varios extremos libres, en los que se pueden acoplar y ser transportadas moléculas de distinta naturaleza, desde agentes terapéuticos hasta moléculas fluorescentes. En su estudio, Baker aplicó una poderosa medicina contra el cáncer, metotrexato, a algunas ramas del dendrímero. En otras, incorporó agentes fluorescentes, así como ácido fólico o folato, una vitamina necesaria para el funcionamiento celular. "Es como un caballo de Troya. Las moléculas del folato en la nanopartícula se aferran a los receptores de las membranas celulares y éstas piensan que están recibiendo la vitamina. Al permitir que el folato traspase la membrana, la célula también recibe el fármaco que la envenena", señaló el investigador.
Las enfermedades infecciosas son otro de los grandes objetivos de la medicina actual. Por eso, la profesora Alonso y su equipo han desarrollado también nanopartículas que permiten administrar, en forma de simples gotas nasales, algunas vacunas que hasta ahora debían inyectarse. Su eficacia ha sido demostrada, hasta el momento, para las vacunas anti-tetánica y anti-diftérica. "Recientemente, hemos propuesto estas tecnologías al concurso de ideas promovido por la Fundación Bill & Melinda Gates para resolver los grandes problemas de salud del tercer mundo", añade la investigadora. "Nuestra idea para administrar de esta forma la vacuna de la Hepatitis B fue una de las seleccionadas de un total de 1.500 presentadas".
No menos importante es la batalla que en estos momentos se libra en todo el mundo contra la diabetes, y en la que la nanotecnología tiene mucho que decir. Las nanopartículas desarrolladas por Alonso y su equipo están siendo utilizadas en experimentos en la clínica para estudiar su uso como vehículos para administrar insulina por vía oral, nasal o pulmonar. Por su parte, la doctora Tejal Desai, profesora de bioingeniería en Boston, ha creado un dispositivo que puede ser inyectado en el torrente sanguíneo y actuar como páncreas artificial, liberando insulina. La técnica desarrollada por esta investigadora consiste en encapsular células que producen la insulina en contenedores con paredes con nanoporos, que por su tamaño sólo pueden ser atravesados por moléculas como el oxígeno, la glucosa o la insulina. De esta forma, las paredes de la cápsula impiden que estas células productoras de insulina sean reconocidas como extrañas por los anticuerpos, mientras que los poros permiten la liberación de la insulina y la entrada de nutrientes, como azúcares y nutrientes. La innovadora técnica tiene potencial para la cura de otras enfermedades tales como la enfermedad de Parkinson, por medio de la liberación de dopamina en el cerebro, o el Alzheimer.
Afinar el diagnóstico
Si las terapias están experimentando cambios drásticos, el diagnóstico no se queda atrás. De la mano de la nanotecnología nos adentramos en la era del diagnóstico molecular, sofisticado y preciso, que hace posible identificar enfermedades genéticas, infecciosas o incluso pequeñas alteraciones de proteínas de forma precoz.
 No en vano, esta disciplina ha contribuido a la creación de biochips, que permiten la obtención de grandes cantidades de información trabajando a una escala muy pequeña. Con los biochips a nanoescala es posible conseguir en poco tiempo abundante información genética -tanto del individuo como del agente patógeno-, que permitirá elaborar vacunas, medir las resistencias de las cepas de la tuberculosis a los antibióticos o identificar las mutaciones que experimentan algunos genes y que desempeñan un papel destacado en ciertas enfermedades tumorales, como el gen p53 en los cánceres de colon y de mama.
No en vano, esta disciplina ha contribuido a la creación de biochips, que permiten la obtención de grandes cantidades de información trabajando a una escala muy pequeña. Con los biochips a nanoescala es posible conseguir en poco tiempo abundante información genética -tanto del individuo como del agente patógeno-, que permitirá elaborar vacunas, medir las resistencias de las cepas de la tuberculosis a los antibióticos o identificar las mutaciones que experimentan algunos genes y que desempeñan un papel destacado en ciertas enfermedades tumorales, como el gen p53 en los cánceres de colon y de mama.
El desarrollo de sensores a escala molecular parece no tener límites. Hace poco, un equipo de científicos de la Universidad de Harvard descubría que se pueden utilizar hilos ultrafinos de silicio para detectar la presencia de virus individuales, en tiempo real y con una gran precisión. Charles M. Lieber, profesor de Química en Harvard y coautor del descubrimiento, asegura que las posibilidades de estos detectores, que pueden ser ordenados en matrices capaces de detectar literalmente miles de virus diferentes, "podrían introducirnos en una nueva era en materia de diagnósticos, seguridad biológica y respuestas a brotes víricos". En el ambiente clínico, la extremada sensibilidad de las matrices de nanohilos permitiría detectar infecciones virales en sus primeros estadios, cuando el sistema inmunológico aún es incapaz de actuar.
Nano-robots
Más lejos quedan, de momento, las máquinas moleculares de reparación que viajarán a través del torrente sanguíneo, con capacidad de actuar sobre el ADN (enfermedades genéticas), modificar proteínas o incluso destruir células completas, en el caso de tumores. Sin embargo, algunos expertos se han atrevido ya a adelantar cómo serán esos futuros nano-robots.
Es el caso de Robert Freitas, investigador del Instituto de Fabricación Molecular de California, que ha creado una especie de glóbulo rojo artificial bautizado como respirocito. Con una sola micra de diámetro, este robot esférico imita la acción de la hemoglobina natural que se encuentra en el interior de los hematíes, aunque con la capacidad de liberar hasta 236 veces más oxígeno por unidad de volumen que un glóbulo rojo natural. Los respirocitos incorporarán sensores químicos, así como sensores de presión. De esta forma estarán preparados para recibir señales acústicas del médico, que utilizará un aparato transmisor de ultrasonidos para darles órdenes con el fin de que modifiquen su comportamiento mientras están en el interior del cuerpo del paciente.

Freitas ha diseñado también los microbívoros, fagocitos mecánicos concebidos para destruir cualquier microbio de nuestro torrente sanguíneo. Utilizando un protocolo digestivo y de descargas actuarán, según estima su creador, hasta 1000 veces más rápido que las defensas naturales.


 pesadilla para el cáncer. El combate de la enfermedad a escala molecular permite detectar precozmente la enfermedad, identificar y atacar de forma más específica a las células cancerígenas. Por eso, el Instituto Nacional del Cáncer de Estados Unidos (NCI) ha puesto en marcha la
pesadilla para el cáncer. El combate de la enfermedad a escala molecular permite detectar precozmente la enfermedad, identificar y atacar de forma más específica a las células cancerígenas. Por eso, el Instituto Nacional del Cáncer de Estados Unidos (NCI) ha puesto en marcha la  No en vano, esta disciplina ha contribuido a la creación de biochips, que permiten la obtención de grandes cantidades de información trabajando a una escala muy pequeña. Con los biochips a nanoescala es posible conseguir en poco tiempo abundante información genética -tanto del individuo como del agente patógeno-, que permitirá elaborar vacunas, medir las resistencias de las cepas de la tuberculosis a los antibióticos o identificar las mutaciones que experimentan algunos genes y que desempeñan un papel destacado en ciertas enfermedades tumorales, como el gen p53 en los cánceres de colon y de mama.
No en vano, esta disciplina ha contribuido a la creación de biochips, que permiten la obtención de grandes cantidades de información trabajando a una escala muy pequeña. Con los biochips a nanoescala es posible conseguir en poco tiempo abundante información genética -tanto del individuo como del agente patógeno-, que permitirá elaborar vacunas, medir las resistencias de las cepas de la tuberculosis a los antibióticos o identificar las mutaciones que experimentan algunos genes y que desempeñan un papel destacado en ciertas enfermedades tumorales, como el gen p53 en los cánceres de colon y de mama. 